Trabajo
Ácidos Carboxilicos
Presentado A:
Jhon Fredy Botero
Presentado Por:
Forero Rodriguez Yuleismy Katherin
Grado
11-2
Fecha
3 septiembre 2013
ACIDOS CARBOXILICOS
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
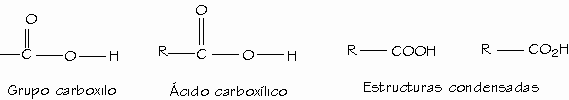
Los ácidos carboxílicos se clasifican de acuerdo con el sustituyente unido al grupo carboxilo. Un ácido alifático tiene un grupo alquilo unido al grupo carboxilo, mientras que un ácido aromático tiene un grupo arilo. Un ácido carboxílico cede protones por ruptura heterolítica de enlace O-H dando un protón y un ión carboxilato.
PROPIEDADES
Físicas
Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. La presencia de dobles enlaces (especialmente dobles enlaces cis) en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusión más bajo.
Los puntos de fusión de los ácidos dicarboxílicos son muy altos. Teniendo dos carboxilos por molécula , las fuerzas de los puentes de hidrógeno son especialmente fuertes en estos diácidos: se necesita una alta temperatura para romper la red de puentes de hidrógeno en el cristal y fundir el diácido.
2. Puntos de fusión.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar. Así, los puentes de hidrógeno de dímero cíclico no se rompen cuando se disuelve el ácido en un solvente polar.
Un ácido carboxílico se puede disociar en agua para dar un protón y un ión carboxilato. La constante de equilibrio Ka para esta reacción se llama constante de acidez. El pKa de un ácido es el logaritmo negativo de Ka, y normalmente se usa al pKa como indicación de la acidez relativa de diferente ácidos.
- solubilidades
Un sustituyente que estabilice al ión carboxilato, con carga negativa, aumenta la disociación y produce un ácido más fuerte. De este modo los átomos electronegativos aumentan la fuerza de un ácido. Este efecto inductivo puede ser muy grande si están presentes uno o más grupos que atraen electrones en el átomo de carbono alfa.
La magnitud del efecto de un sustituyente depende de su distancia al grupo carboxilo. Los sustituyentes en el átomo de carbono alfa son los más eficaces para aumentar la fuerza de un ácido. Los sustituyentes más distantes tienen efectos mucho más pequeños sobre la acidez, mostrando que los efectos inductivos decrecen rápidamente con la distancia.
4. Sales de ácidos carboxilicos.
Una base fuerte puede desprotonar completamente en un ácido carboxílico. Los productos son el ión carboxilato, el catión que queda de la base, y agua. La combinación de un ión carboxilato y un catión constituyen la sal de un ácido carboxílico.
5. Síntesis de los ácidos carboxilicos.
- Efectos de los sustituyentes sobre la acidez.
Los alcoholes o aldehídos primarios se oxidan normalmente para producir los ácidos empleando ácido crómico. El permanganato de potasio se emplea en ocasiones pero con frecuencia sus rendimientos son inferiores.
- Oxidación de alcoholes y aldehídos.
El permanganato de potasio reacciona con los alquenos para dar glicoles. Las soluciones calientes y concentradas de permanganato de potasio oxidan más los glicoles, rompiendo el enlace carbono-carbono central. Dependiendo de la sustitución del doble enlace original, se podrán obtener cetonas o ácidos.
La ozonólisis o una oxidación vigorosa con permanganato rompe el triple enlace de los alquinos dando ácidos carboxílicos
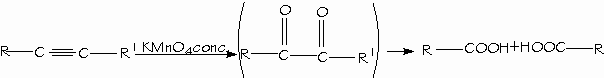
- Ruptura oxidativa de alquenos y alquinos.
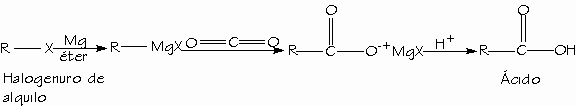
- Carboxilación de reactivos de Grignard.
Para convertir un halogenuro de alquilo en ácido carboxílico con un átomo de carbono adicional es desplazar al halogenuro con cianuro de sodio. El producto es un nitrilo con un ácido carboxílico más.
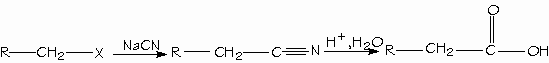
QUÍMICAS
Aunque los ácidos carboxílicos contienen también al grupo carbonilo, sus reacciones son muy diferentes de las de las cetonas y los aldehídos. Las cetonas y los aldehídos reaccionan normalmente por adición nucleofílica del grupo carbonilo, pero los ácidos carboxílicos y sus derivados reaccionan principalmente por sustitución nucleofílica de acilo, donde un nucleófilo sustituye a otro en el átomo de carbono del acilo (C=O).
- Formación de hidrólisis de nitrilos.
Los mejores reactivos para convertir los ácidos carboxílicos en cloruros de ácido son el cloruro de tionilo (SOCl2) y el cloruro de oxalilo (COCl)2, porque forman subproductos gaseosos que no contaminan al producto. El cloruro de oxalilo es muy fácil de emplear porque hierve a 62ºC y se evapora de la mezcla de reacción.
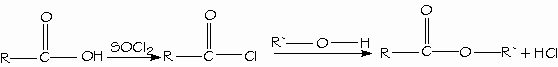
Los ácidos carboxílicos se convierten directamente en ésteres mediante la esterificación de Fischer, al reaccionar con un alcohol con catálisis ácida.
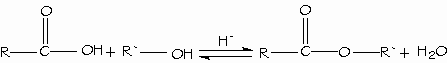
- Condensación de los ácidos con los alcoholes. Esterificación de Fischer.
El hidruro de litio y aluminio (LiAlH4) reduce los ácidos carboxílicos para formar alcoholes primarios. El aldehído es un intermediario en esta reacción, pero no se puede ailar porque se reduce con mayor facilidad que el ácido original.
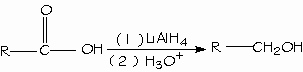
- Reducción de los ácidos carboxílicos.
Un método general para prepara cetonas es la reacción de un ácido carboxílico con 2 equivalentes de un reactivo de organolitio.
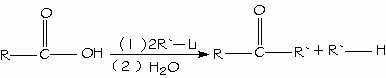
Los ácidos carboxílicos se pueden convertir en halogenuros de alquilo con pérdida de un átomo de carbono mediante la reacción de Hunsdiecker.
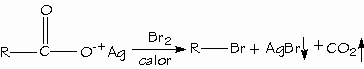
NOMENCLATURA
La IUPAC nombra los ácidos carboxílicos reemplazando la terminación -ano del alcano con igual número de carbonos por -oico.


Cuando el ácido tiene sustituyentes, se numera la cadena de mayor longitud dando el localizador más bajo al carbono del grupo ácido. Los ácidos carboxílicos son prioritarios frente a otros grupos, que pasan a nombrarse como sustituyentes.

Los ácidos carboxílicos también son prioritarios frente a alquenos y alquinos. Moléculas con dos grupos ácido se nombran con la terminación -dioico.

Cuando el grupo ácido va unido a un anillo, se toma el ciclo como cadena principal y se termina en
-carboxílico.
-carboxílico.
OBTENCIÓN
Se obtienen por oxidación enérgica de los alcoholes primarios o por oxidación suave de los aldehídos.
Reducción de Ácidos Carboxílicos.
Los ácidos carboxílicos son reducidos por hidruros fuertes, como el hidruro de litio y aluminio, para formar alcoholes primarios. Sin embargo, la reacción es difícil, y con frecuencia se requiere calentamiento en tetrahidrofurano como solvente para que se complete.
El borano, BH3 también se utiliza para la conversión de ácidos carboxílicos en alcoholes primarios. La reacción de un ácido con borano ocurre con rapidez a temperatura ambiente, y a menudo se prefiere este procedimiento al de reducción LiAlH4 debido a su relativa seguridad, facilidad y especificidad. El borano reacciona en ácidos carboxílicos más rápido que con cualquier otro grupo funcional, de modo que permite realizar transformaciones selectivas como la que se muestra con ácidos p-nitrofenilacetico
USOS EN LA INDUSTRIA
Algunos ácidos carboxílicos muy utilizados en la industria son:
- El ácido fórmico se utiliza como conservador en la industria cervecera y vitivinícola. Se emplea en el teñido de telas y en curtiduría.
- El ácido acético (vinagre) es el más usado. Se emplea para preparar acetona, rayón, solvente de lacas y resinas. Con el ácido salícilico forma la aspirina.
- Se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, también para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas.
- El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial.
- Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
- Ácido acrílico Nombre común del ácido propénico. Este compuesto orgánico es un líquido incoloro, inflamable, cáustico y de olor punzante, con una temperatura de ebullición de 142 ºC. El ácido acrílico es el ácido carboxílico insaturado más sencillo; sus sales y ésteres se denominan acrilatos. Su reacción principal es la polimerización: los poliacrilatos resultantes son a menudo transparentes pero quebradizos. Para modificar sus propiedades físicas y químicas, pueden combinarse con otros componentes (copolimerización). Así, el ácido acrílico es el material de partida para fabricar plásticos, barnices, resinas elásticas y adhesivos transparentes.
- Ácido benzoico: Sólido de fórmula C6H5—COOH, poco soluble en agua y de acidez ligeramente superior a la de los ácidos alifáticos sencillos. Se usa como conservador de alimentos. Es poco tóxico y casi insípido. El ácido benzoico se combina con el ácido salicílico en forma de pomada con propiedades antimicóticos. Puede aplicarse sin peligro a la piel.
- Ácido fumárico: Ácido trans-butenodioico, compuesto cristalino incoloro, de fórmula HO2CCH=CHCO2H, que sublima a unos 200 °C. Se encuentra en ciertos hongos y en algunas plantas, a diferencia de su isómero cis, el ácido maleico (cis-butenodioico), que no se produce de forma natural.Se utiliza en el procesado y conservación de los alimentos por su potente acción antimicrobiana, y para fabricar pinturas, barnices y resinas sintéticas.
- Ácido linoleico: Líquido oleoso, incoloro o amarillo pálido, de fórmula CH3(CH2)4(CH=CHCH2)2(CH2)6CO2H, cuyos dobles enlaces presentan configuración cis. Es soluble en disolventes orgánicos y se polimeriza con facilidad, lo que le confiere propiedades secantes. El ácido linoleico es un ácido graso esencial, es decir, es un elemento necesario en la dieta de los mamíferos por ser uno de los precursores de las prostaglandinas y otros componentes de tipo hormonal. Se encuentra como éster de la glicerina en muchos aceites de semillas vegetales, como los de linaza, soja, girasol y algodón. Se utiliza en la fabricación de pinturas y barnices.
- Ácido oleico: Líquido oleoso e incoloro, de fórmula CH3(CH2)7CH=CH(CH2)7CO2H en su configuración cis (la cadena de carbono continúa en el mismo lado del doble enlace). Es un ácido graso no saturado que amarillea con rapidez en contacto con el aire. Por hidrogenación del ácido oleico se obtiene el ácido esteárico (saturado). No es soluble en agua, pero sí en benceno, alcohol, éter y otros muchos disolventes orgánicos. Se solidifica por enfriamiento y funde a 14 °C. Su isómero trans (ácido elaídico) es sólido y funde a 51 °C; se puede obtener por calentamiento del ácido oleico en presencia de un catalizador.
Junto con el ácido esteárico y el ácido palmítico se encuentra, en forma de éster, en la mayoría de las grasas y aceites naturales, sobre todo en el aceite de oliva. Se obtiene por hidrólisis del éster y se purifica mediante destilación. Se utiliza en la fabricación de jabones y cosméticos, en la industria textil y en la limpieza de metales.
- Ácido salicílico: Sólido blanco y cristalino, que se encuentra en numerosas plantas, en especial en los frutos, en forma de metilsalicilato, y se obtiene comercialmente a partir del fenol. Tiene un sabor ligeramente dulce; es poco soluble en agua y más soluble en alcohol, éter y cloroformo. Tiene un punto de fusión de 159 °C. Este ácido se emplea sobre todo para preparar algunos ésteres y sales importantes. El salicilato de sodio, que se obtiene tratando el fenolato de sodio con dióxido de carbono a presión, se usa para preservar alimentos y en mayor medida para elaborar preparados antisépticos suaves como pasta de dientes y colutorios. Los compuestos salicílicos medicinales empleados como analgésicos y antipiréticos son el ácido acetilsalicílico y el fenilsalicilato, que se venden bajo el nombre comercial de aspirina y salol, respectivamente. El metilsalicilato es el principal componente del aceite de gaulteria o esencia de Wintergreen, y se fabrica sintéticamente en grandes cantidades por reacción de ácido salicílico y metanol.
- Ácido caprílico o Ácido undecilénico: Líquido amarillo de fórmula CH3(CH2)4COOH, con olor a rancio característico, de actividad fungicida contra diversos hongos. El ácido caprílico y sus sales presentan acción dermatomicótica.
- Ácido esteárico: Sólido orgánico blanco de apariencia cristalina, de fórmula CH3(CH2)16COOH. No es soluble en agua, pero sí en alcohol y éter. Junto con los ácidos láurico, mirístico y palmítico, forma un importante grupo de ácidos grasos. Se encuentra en abundancia en la mayoría de los aceites y grasas, animales y vegetales, en forma de éster—triestearato de glicerilo o estearina— y constituye la mayor parte de las grasas de los alimentos y del cuerpo humano. El ácido se obtiene por la hidrólisis del éster, y comercialmente se prepara hidrolizando el sebo. Se utiliza en mezclas lubricantes, materiales resistentes al agua, desecantes de barnices, y en la fabricación de velas de parafina. Combinado con hidróxido de sodio el ácido esteárico forma jabón (estearato de sodio).
El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial.
Ácido etanoico o Ácido acético: Líquido incoloro, de fórmula CH3 COOH, de olor irritante y sabor amargo. En una solución acuosa actúa como ácido débil. El ácido etanoico puro recibe el nombre de ácido etanoico glacial, debido a que se congela a temperaturas ligeramente más bajas que la ambiente. En mezclas con agua solidifica a temperaturas mucho más bajas. El ácido etanoico es miscible (mezclable) con agua y con numerosos disolventes orgánicos.
Las soluciones diluidas (de 4 a 8%) preparadas de este modo a partir del vino, sidra o malta constituyen lo que conocemos como vinagre. El ácido etanoico concentrado se prepara industrialmente mediante distintos procesos, como la reacción de metanol (alcohol metílico) y de monóxido de carbono (CO) en presencia de un catalizador, o por la oxidación del etanal (acetaldehído).
El ácido acético se utiliza en la producción de acetato de rayón, plásticos, películas fotográficas, disolventes para pinturas y medicamentos como la aspirina. Tiene un punto de ebullición de 118 °C y un punto de fusión de 17 °C
Los efectos sobre la salud de los ácidos grasos insaturados
Los ácidos grasos insaturados se han asociado con varias otras enfermedades y, aunque las pruebas no son concluyentes, es un ámbito que está siendo objeto de un enorme interés. La materia grasa en la dieta afecta a varias vías metabólicas diferentes incluidas las que participan en el control de la glucemia. Por tanto, los tipos y cantidades de grasas de la dieta pueden desempeñar un papel en la gestión de la diabetes tipo 2
La detección de asociaciones entre los componentes de la dieta y el riesgo de diversas enfermedades es muy compleja y, en muchos casos, todavía se están acumulando pruebas. Las enfermedades cardiovasculares, caracterizas por el endurecimiento y estrechamiento de los vasos sanguíneos y/o el desarrollo de coágulos de sangre, es una de las principales causas de mortalidad y morbilidad en todo el mundo.
Beneficios en la salud de los ácidos grasos insaturados
El tipo y la cantidad total de materia grasa en la dieta desempeñan claramente una función en la manera en la que afectan al nivel de riesgo de enfermedad de una persona, a pesar de ello, siguen sin ser claros los mecanismos precisos mediante los cuales los ácidos grasos reducen el riesgo de enfermedades cardiovasculares.
Los ácidos grasos insaturados también pueden estar asociados con la disminución en el riesgo de desarrollar determinados tipos de cáncer como el cáncer de colon, mama y próstata.
Los ácidos grasos, la nutrición y las enfermedades cardiovasculares
La alimentación es una fuente importante de ácidos grasos. Esta contribución es vital para mantener un nivel de lípidos estable y para suministrar al cuerpo los ácidos grasos esenciales. Los ácidos grasos calificados de esenciales incluyen los omega-3 y omega-6. El cuerpo humano no puede sintetizarlos, o los sintetiza en cantidades insuficientes, es necesaria por tanto una contribución mínima y regular por medio de la alimentación.
Actualmente, según la AFSSA, la dieta proporciona suficiente omega-6 y muy poco omega-3, con una relación omega-6/omega 3 insuficiente.
Sin embargo, numerosos estudios han demostrado que el exceso de ácidos grasos (especialmente saturadas e insaturados ) podría tener consecuencias para la salud, incluido el aumento de forma significativa del riesgo de problemas cardiovasculares. Algunos estudios se centran en el consumo excesivo de grasas insaturadas procedentes como la hidrogenación parcial de los ácidos grasos de origen vegetal (aceites).
BIBLIOGRAFIA
- http://www.slideshare.net/kripton2010/acidos-carboxilicos-2945643
- Enciclopedia NORMA.
Editorial Norma.
Autor: Francisco Villegas Posada. - Libro de Química Orgánica, Universidad de Chile.
Autor: Anthony Wilbraham - Michael Matta. - *Microsoft ® Encarta ® 2009. © 1993-2008 Microsoft Corporation. Reservados todos los derechos.
- http://es.scribd.com/doc/40276143/ACIDOS-CARBOXILICOS
- Microsoft student con encarta premium












.jpg)



























.png)







